澳大利亚tga( therapeutic goods administration),是澳大利亚政府卫生部机构,负责管理处方药、疫苗、防晒霜、维生素和矿物质、医疗器械、血液和血液制品等治疗用品。任何声称具有治疗功效的产品都必须在澳大利亚治疗用品系统登记(australian register of therapeutic goods,artg),然后才能在澳大利亚销售。
一、医疗器械分类
澳大利亚把医疗器械分为i类、is和im、iia类、iib类、iii类、aimd,产品的分类与欧盟分类类似。
|
classification |
level of risk |
|
class i |
low |
|
class i—supplied sterile class i—incorporating a measuring function class iia |
low–medium |
|
class iib |
medium-high |
|
class iii |
high risk |
|
active implantable medical devices (aimd) |
二、符合性评估流程
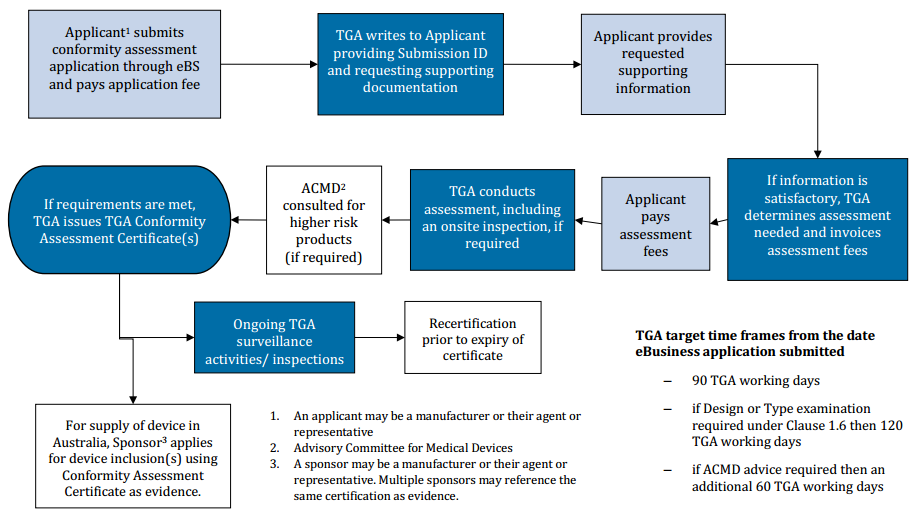
1. 申请者以ebs形式提交符合性评估申请并支付申请费用
2. tga回复申请者,提供递交id号,并要求申请者提交支持文件
3.申请者提供所需的支持信息
4. 如果信息符合要求,tga确定所需的评审和评审的费用
5. 申请者支付评审费用
6.tga实施评审,包括现场审核(如需要)
7.高风险产品(如有)的acmd咨询
8. 如果满足要求,tga颁发符合性评估证书
9.tga持续监督和检查
10.证书过期前重新认证
三、注册流程
1.确定产品类别
2.指定一名澳代(australian sponsor),由澳代协助产品注册和作为与tga之间的联系人
3.编写技术文档、研发文档和符合性声明
4.澳代提交制造商的信息(如ce证书)到tbs(tga business services)系统供tga审核
5.澳代在tbs系统提交医疗器械申请,包括产品描述、gmdn码,并支付申请费用。如有临床要求,需要提交临床证据
6. tga将评审设计开发资料(适用于ⅱb类和ⅲ类)
7.通过tga审核,将公布artg(australian register of therapeutic goods)列名号,并将注册信息登记在artg数据库上
8.产品上市,每年支付年费
相关产品:澳大利亚医疗器械注册